AOP(Adverse Outcome Pathways)に関する話。
ETCに出ていた以下のcompanion papers+αを読んで、AOPの理解が進んだので備忘録的に書いておきます。どちらもOpen Accessです。
ざっくり言うと、「AOPは個々に独立しているわけではなく別の複数のAOPsと関連しあっているので、複数のAOPsをまとめて考えることが大事だよね、AOP Networkを考えようぜ」という論文たちです。
Knapen D, Angrish MM, Fortin MC, Katsiadaki I, Leonard M, Margiotta‐Casaluci L, Munn S, O'Brien JM, Pollesch N, Smith LC, Zhang X, Villeneuve DL, 2018, Adverse outcome pathway networks I: development and applications, Environ Toxicol Chem, 37(6):1723-1733.
Villeneuve DL, Angrish MM, Fortin MC, Katsiadaki I, Leonard M, Margiotta‐Casaluci L, Munn S, O'Brien JM, Pollesch N, Smith LC, Zhang, X, Knapen D, 2018, Adverse outcome pathway networks II: network analytics, Environ Toxicol Chem, 37(6):1734-1748.
そもそもAOPって何?
AOPは、「外的なストレスが生物体内のどの部位にどのように作用し、有害影響(Adverse Outcome; AO)を引き起こすか」というつながりを整理する枠組みのことで、「有害性発現経路」とか「有害性転帰経路」、「毒性発現経路」なんて訳語もあるそうです。
例えば下の図のような感じ。アセチルコリンエステラーゼ阻害から致死・個体群減少に至るAOPの例(参考:Russomら, 2014, AOP16)。有機リン系殺虫剤などは体内に取り込まれると、アセチルコリンエステラーゼ(AChE)と結合し、その酵素活性を阻害します。これが曝露後に分子レベルで生じる最初期の応答(Molecular Initiating Event; MIE)です。その後、アセチルコリンが蓄積していき、痙攣や心拍数の増加など細胞・組織レベルの応答(Key Event; KE)を引き起こし、最悪の場合、死亡や個体群の減少につながります(=AO)。このように、外的ストレスによる生体機能のかく乱を、複数の生物学的階層をまたぐ一つの経路として捉えるのがAOPです。

コンセプトの詳しい説明は、Gerald Ankley御大が2010年にETCに発表した論文"Adverse outcome pathways: A conceptual framework to support ecotoxicology research and risk assessment"を読むのが良いと思います。
AOPの歴史
ここまでの話だと「AOPの何が新しいのかよく分からん、なぜそんなに盛り上がってんの?」って感じかもしれませんね。まぁ盛り上がってるのに特に理由はなくて流行ってそんなもの、と言われればそうかも。
それに実際、AOPみたいな研究は古くからあるみたいです。
LaLoneら(2017, ETC)によると、分子レベルの動きを化学物質曝露と関連づけた研究は1975年から存在してて(Payne and Penrose, 1975)*1、1989年には"Biomarkers: Biochemical, Physiological, and Histological Markers of Anthropogenic Stress"と題するSETACのワークショップが開かれてます。ただ、ここまでは分子レベルの応答が曝露の指標として使えるかという側面が強く、現在のAOPとはまだ開きがありますね。
今のAOP的な考えがほぼ確立するのが2000年代です、たぶん。2007年にNRCが「21世紀の毒性試験 (Toxicity Testing in the 21st Century)」という報告書を出しており、この中で毒性の発現経路に着目してハイスループットなin vivo試験やin sillico解析を活用することの重要性が述べられているそうです(参考:林, 2013)。この報告書は化学物質によるヒト健康リスクを念頭に置いてますが、その延長で生態リスク評価・管理へ応用するときにAOPが出現してきたっぽいです。AOPという言葉が論文で初めて使われたのは、上述のAnkleyら (2010) です。
AOPの概念はヒト健康リスクの研究から生まれてますが、AOPという用語は上述のAnkleyら (2010) が初出で生態毒性分野から使われ始めました。ヒトの皮膚感作性試験ではAOPの構築が構築がかなり進んでいるので(AOP:40)、てっきりその周辺から生まれた言葉かと思っていましたが、逆輸入だったようです。
生物学・毒性学などとの違い
AOPが盛り上がっているように見えるのは、化学物質管理や毒性試験のあり方にコミットすることを目指した実学的なものだからかもしれません。
AOPは毒性の生物学的なメカニズムをすべて明らかにすることを主目的としていません。Villeneuveら (2018) も、AOP networkはbiological fidelityよりpredictive utilityを重視しており、weight of evidenceが十分なら全てのKey Eventsを盛り込む必要はないと述べています。確かに上述のAChE阻害のAOPも、3つ目のKEから致死まではかなり適当というか、間に何か入っていても良さそうなものです。
AOP Networkの概要
で、ようやく本題のAOP Netowrkですが、KE(MIE・AO含む)を共有する既存のAOPsをつなげます。例えばアロマターゼ阻害による繁殖能阻害に関するAOP (AOP25) は下図のように整理されてます。
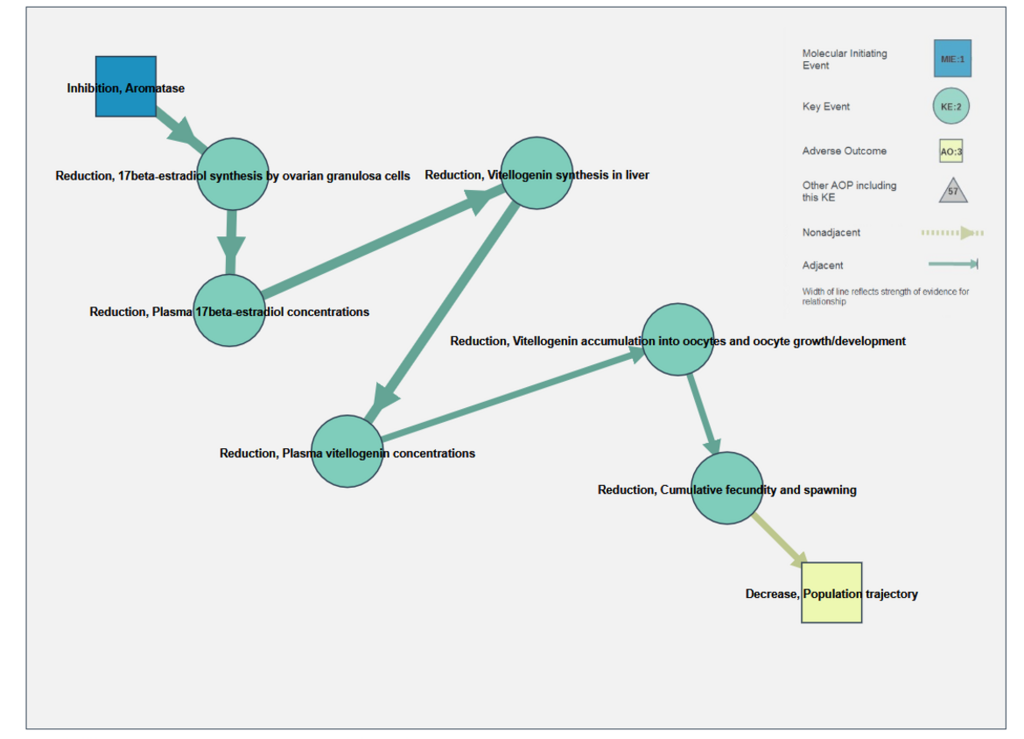
これだけだと単純な経路ですが、KEを共有する他のAOPsを表示すると下図のようになります。ごちゃごちゃしてますが、灰色の三角が他のAOPsを表してます。
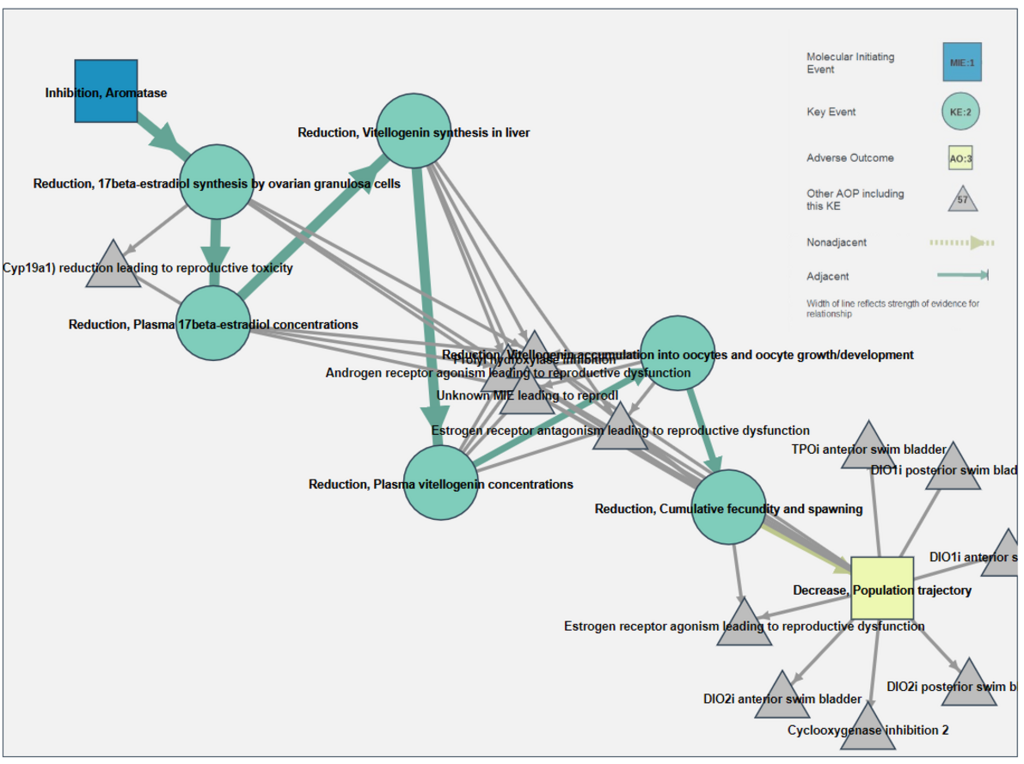
AOP25とKEを共有している一例がAOP122。4つ目のKE(17β-estradiol synthesis by ovarian granulosa cellsのreduction)以降は、全てAOP25と一緒ですね。
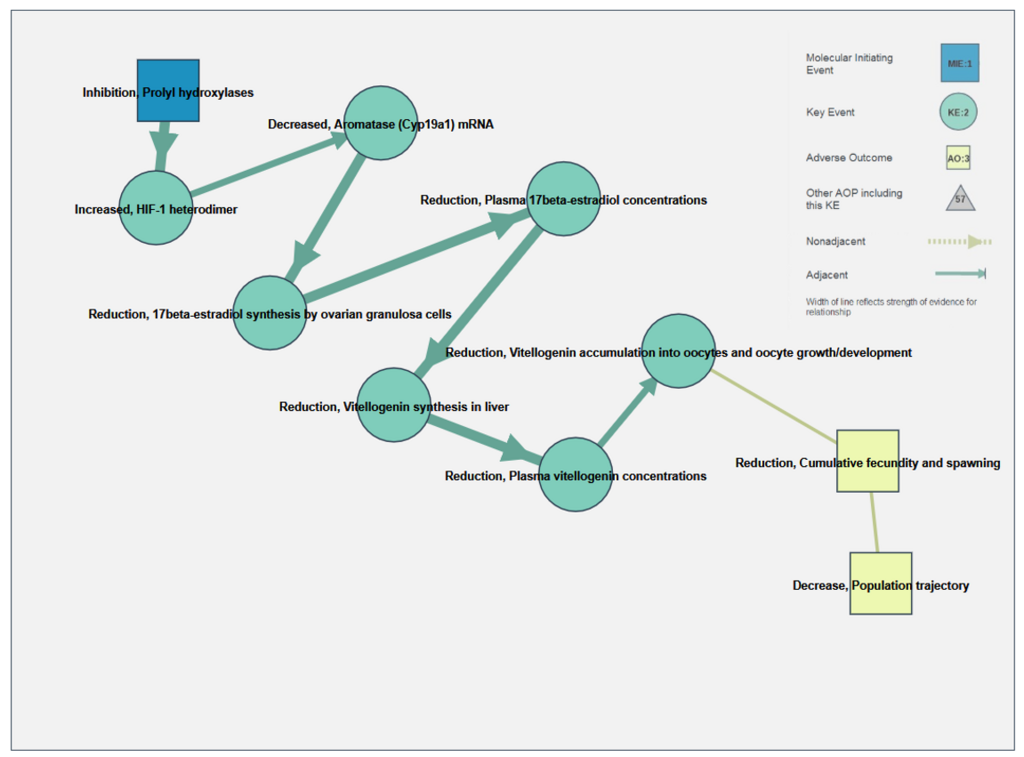
こういった共通部分のあるAOPsをまとめていくと Villeneuveら (2018) のFig. 1のようなAOP Networkができます。Fig.1を見ると、"17β-estradiol synthesis by ovarian granulosa cellsのreduction"は5つのKEの下流にあって1つのKEの上流にありAOP networkの収束点(point of convergence)だと分かります。
このようにAOP networkの収束・発散を調べることで、適切な毒性試験法の設計や複合毒性の評価につなげられると期待されています。例えば収束するAOP networkは相加あるいは相乗毒性につながるのでは、とのことです。しかし、論文を読んだ印象では定量的な議論が可能な状態ではなく、まだまだコンセプト段階ですね。
Knapenら, 2018の後半でちょこっと述べられている排水のハザード同定の話がAOP networkの活用例として面白かったです。排水の有機溶媒抽出物にToxCast in vitro assayを適用して、その結果をAOP wikiと照らし合わせAOP networkを構築し、水生脊椎動物に生じうるハザードを同定する、というもの。エストロゲン受容体アゴニストによる繁殖能低下とかAhR受容体活性化による胚死亡などがハザードとして挙げられているので、既存のAOP wikiの情報量によって大きなバイアスがかかっている気はしますが、方向性は面白いです。
AOP Networkの課題
上の2つの論文(Knapenら, 2018とVilleneuveら, 2018 )ではAOP networkの課題がいくつかあげられてます。AOPではKEが方向性を持つので、同じ現象を扱う場合でも異なるKEに分類されてしまい(例:Increase, vitellogenin synthesisとReduction, vitellogenin synthesis)、networkの解釈が難しい、とか。AOP wikiにのっている多くのAOPsは質の担保がなされていない、とか。
個人的に一番問題だと思ったのは、現状では分かっているAOPsが少なすぎて、あるいは既存のAOPsでもKE間の根拠が薄弱で、実際の環境汚染を対象にできるほど複雑かつ精緻なAOP networkを構築できないのではないか、ということです。「AOPは発展途上だ」とか「AOPは日々更新されていく」みたいな文言はよく見ますが、企画倒れにならないで欲しいものです…。
また、 Knapenら, 2018を読むとAOP networkを図示できる便利なツールがあるように思えましたが、全然そんなことはなかったです。Cytoscapeのプラグインとして紹介されているAOPXplorerを試しに使ってみましたが、既存の複数のAOPsのまとまりをネットワークとして図示してくれるだけで、 Knapenら, 2018のFig.1で示されているようなextractionとかfilteringとかはほぼ対応していません…。まだまだこれから、ということでしょうか。
最後の方でダメ出しばかりになってしまったので、期待していることを一つ。どうやらAOP-DBというウェブ上での検索機能付きのデータベースが今開発中とのこと。AOP-DB(AOP knowledgebaseと名前ややこしい…)は、KEGG pathwayやGene Ontologyなど既存の生物学の用語とAOPsを結び付け、さらにAOPと化学物質との関連も示してくれるそうです。既存のデータベースを統合しているだけではありますが、こういうツールがあるとエンドユーザーとしてはとても助かります。
Pittman ME, Edwards SW, Ives C, Mortensen HM, 2018, AOP-DB: A database resource for the exploration of Adverse Outcome Pathways through integrated association networks, Toxicol Applied Pharmacol, 343:71-83.
(追記 2018.07.19)
ツールはEffectopediaの方が優れているかも?まだほとんど試してませんが・・・。使ってみてからまた追記するかも。
*1:brown troutとカラフトシシャモのAryl Hydrocarbon Hydroxylase (CYP1A1) と石油曝露の関係を調べた論文。CYP1A1の曝露のバイオマーカーとしての利用可能性を調べただけで、Laloneらの言うようにadverse effectsとの関係は見ていない気がするが・・・。







 (
(



 (
(



